В біології білки — природні високомолекулярні органічні сполуки, побудовані з залишків 20 амінокислот, сполучених пептидними зв’язками в поліпептидні ланцюги. Протягом життя всіх організмів вони виконують структурну, регуляторну, каталітичну, транспортну, захисну, енергетичну та інші функції. Класифікація білків в більшій мірі обумовлюється і будується на різних, часто випадкових, ознаках.
Про класифікацію білків
Складність побудови і великі розміри молекул, колосальне розмаїття функцій білків робить важким завданням розробку єдиної і чіткої їх класифікації на якійсь одній основі і не дозволяє розділити їх, не виключивши деякі унікальні білки. Класифікувати можливо за їх складом, функціями та структурою.
Про класифікацію білків
Класифікація по складності
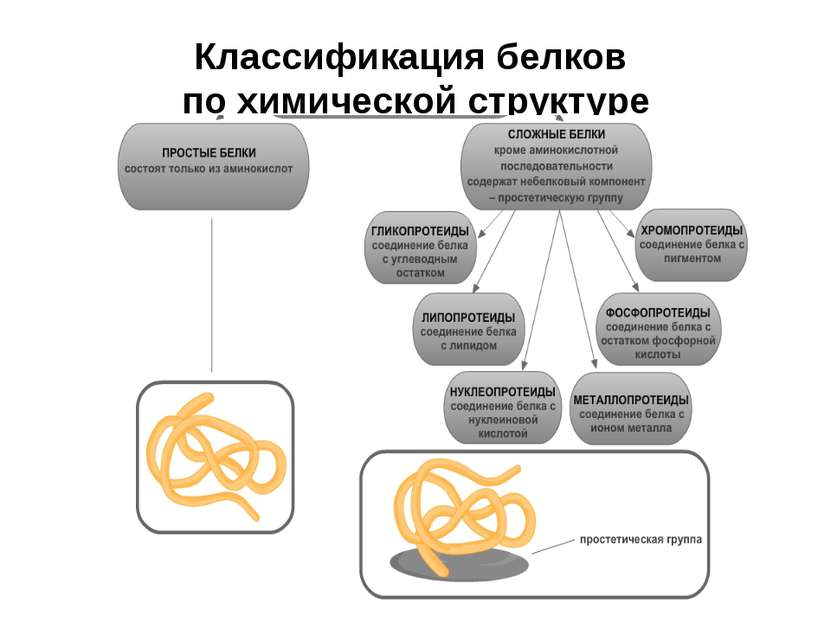
У біохімії, виходячи з рівня складності будови, їх прийнято ділити на 2 групи — прості і складні білки. Перші класифікують ще за розчинності.
Класифікація простих білків:
- альбуміни — добре розчиняються у воді, розчинах солей різних концентрацій, лугах і кислотах;
- глобуліни — слабогидрированные речовини. Вони розчиняються в розбавлених нейтральних солях невеликих концентрацій, лугах і кислотах, але вони не розчиняються у воді;
- протамины – низькомолекулярні лужні білки. У їх склад входить до 80% лізину і аргініну. Вони добре розчиняються у воді, кислому, нейтральному та лужному середовищах;
- проламины розчиняються в розбавлених (60-80%) етанолі, слабких кислотах і лугах, але вони стійкі до води, сольових розчинів, а також абсолютного етилового спирту. Їх хороша розчинність в етанолі пов’язана з неполярностью радикала проліну;
- глютелины — білки, розчинні у слабких (0,1-0,2%) розчинах кислот і лугів, але стійкі до води, спиртовим і сольовим розчинників.
За межами даної класифікації простих білків розташовані ті, які володіють сильною стійкістю до всіх зазначених розчинників. Приміром, протеиноиды — білки опорних тканин.
Класифікація складних білків:
- гликопротеиды мають у своєму складі вуглеводний елемент. Ці речовини присутні у всіх тканинах живих організмів і рослин;
- ліпопротеїди — складні білково-ліпідні структури. Приміром, вони служать структурною основою мембран клітини;
- хромопротеиды — білки червоного кольору і флавопротеиды — жовтого. В їх складі присутні іони металів і вітамін В2;
- фосфопротєїди містять ковалентно пов’язані залишки фосфорної кислоти;
- металлопротеиды містять негемовые і пов’язані з розташуванням іони металів;
- нуклеопротеиды беруть участь у біологічних процесах головного ланки, яке служить основою роботи будь-якого організму.
Класифікація за формою
В основі класифікації за формою лежить співвідношення подовжньої і поперечної осей. Виділяють 2 групи:
- до глобулярным відносяться речовини, в яких таке співвідношення не перевищує 1:10 і має еліпсоїдну форму. Вони містять ферменти, імуноглобуліни, певні гормони білкової природи (наприклад, інсулін);
- фібрилярні мають витягнутої, ниткоподібний структурою, в якій співвідношення осей перевищує 1 до 10. Наприклад, протеиноиды, здійснюють в організмі структурну функцію, або міозин, який бере участь у скороченні м’язів.
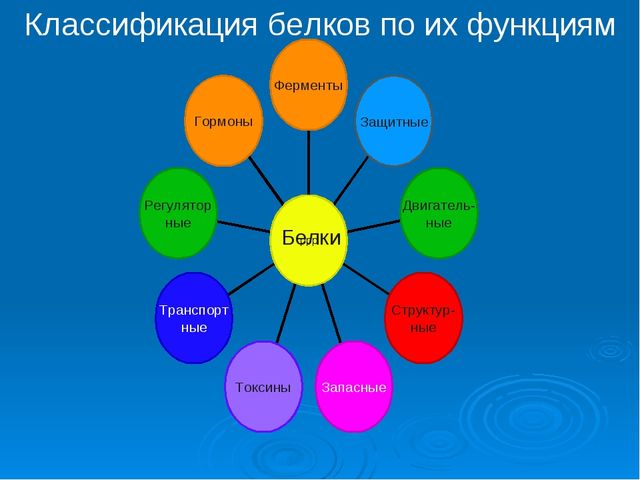
Класифікація білків за функціями
Класифікація білків за функціями
Залежно від функцій білки діляться на:
- ферменти;
- транспортні;
- структурні;
- скорочувальні;
- регуляторні (гормональні);
- захисні;
- запасають білки.
За якою ознакою білки діляться на прості і складні
Принцип такого ділення заснований на складності будови білків і кількості елементів розпаду. Прості відрізняються від складних кількістю компонентів, на яких вони будуються і різницею в продуктах розпаду при гідролізі. У складних білків молекули побудовані з небілкових субстанцій та представлені, наприклад, вуглеводами, нуклеїновими кислотами, ліпідами.
Складні білки
Приклади простих білків:
- проламины містяться, в основному, в насінні злаків. Наприклад, гліадин пшениці, секалин жита;
- протеїн, що міститься в яйцях, м’ясі, рибі і молоці;
- протамины містяться в складі молочко риб, наприклад, клупеин (оселедець), скумбрин;
- альбуміни: яйця курки і сироватковий. До них також відносять рицин насіння рицини, лейкозин зародка зерна пшениці;
- глобуліни входять до складу насіння бобових і олійних культур, наприклад, вицилин (горох), фазеолин (квасоля), арахин (арахіс);
- глютелины є, як правило, у насінні злаків — оризенин рису і глютенін пшениці;
- до протеноидам відносяться, наприклад, кератины, еластин, фібрин, колаген. Колаген надзвичайно широко представлений в організмі і займає близько однієї третини її білків. Є у складі сполучної тканини. З кератинів складаються нігті і волосся. Еластин — білок еластичних волокон, зв’язок і сухожиль. Фібрин сприяє згортання крові в організмі.
Приклади складних білків:
- група ліпопротеїдів. Хиломикроны формуються в слизовій кишечника. Ліпопротеїди утворюються в печінці і в кров’яний сироватці;
- група глікопротеїдів. Муцини знаходяться в секреціях слизових залоз. Мукоиды утворюються в опорних тканинах. Імуноглобуліни і трансферрины є у кров’яній плазмі;
- до фосфопротеидам відноситься казеїн, овальбумин і вителлин;
- металлопротеиды включають гемоціанін і гемэритрин, що транспортують кисень у безхребетних тварин, а також феритин, що міститься в печінці, кістковому мозку і службовець запасом заліза;
- до нуклеопротеидам відносяться дезоксирибонуклепротеиды, що містяться в ядрах клітин – основа хроматину і рибонуклеопротеиды, з яких складаються багато віруси, рибосоми;
- до хромопротеидам відносяться цитохромы, що переносять електрони при клітинному диханні, фотосинтезі, ферменти — каталаза, пероксидаза, руйнують отруйну перекис водню і розкладають його на кисень і воду. Також сюди включаються гемоглобін та міоглобін, які у хребетних розташовуються в еритроцитах, а у безхребетних — у кров’яній плазмі. Вони забезпечують тканини організму киснем.
Важливо! Прості білки шикуються із залишків α-амінокислот і розпадаються при гідролізі тільки на амінокислоти. У складних крім пептидних ланцюгів (простого білка) є елемент неаминокислотного походження — простетичної група. При їх гідролізі, крім амінокислот, вивільняється небелковая частина або продукти її розпаду.
Про функціональних класах
Ферменти — група білків, підвищують швидкість перебігу хімічних реакцій
Функції білків
Короткий огляд функціональних класів білків:
- ферменти — група білків, підвищують швидкість перебігу хімічних реакцій. Сюди відносяться, наприклад, трипсин і пепсин;
- транспортні виконують завдання переносу атомів, молекул, іонів всередині клітини, так і між ними в багатоклітинних організмах. Вони включають, наприклад, альбумін і гемоглобін;
- харчові (запасні) призначені для забезпечення корисними речовинами зародків рослин і тварин на початкових стадіях їх розвитку, наприклад, казеїн та альбумін;
- скоротливі (рухові) забезпечують клітину або організм здатністю скорочуватися, змінювати форму і пересуватися (актин і міозин);
- структурні білки формують волокна, навиті один на одного або укладені плоским шаром, виконують опорну або захисну функцію, що скріплюють біологічні структури організмів і забезпечують їм міцність, наприклад, кератин і колаген;
- захисні охороняють організм від вторгнення сторонніх живих структур або оберігають його від пошкоджень. Наприклад, фібриноген, тромбін;
- регуляторні беруть участь у клітинній або фізіологічної активності, наприклад, інсулін і гормон росту.
Важливо! Необхідно мати на увазі, що із-за недосконалості самої класифікації білків, а також внаслідок виняткової їх різноманіття віднесення до однієї з описуваних тут багатьох окремих груп білків викликає складність.
Білки просто незамінні в підтримці життя організму, а також служать його захистом. Встановити, до якого класу належать білки, буває важко із-за унікальності функцій деяких з них. Останнім часом здійснюються спроби організувати білки сімейства і описати їх домени та мотиви.